L’adaptation au vol a impacté l’évolution du microbiome intestinal des oiseaux et des chauve-souris de façon convergente
La grande majorité des vertébrés possèdent un microbiome intestinal jouant un rôle essentiel notamment dans la digestion. La composition spécifique de ce microbiome est le fruit de millions d’années de coévolution entre les bactéries qui le composent et leurs hôtes. Il en résulte que des espèces phylogénétiquement proches présentent souvent des microbiomes similaires. On parle alors de phylosymbiose. Néanmoins, les facteurs gouvernant l’évolution des communautés bactériennes intestinales sur le long terme restent à préciser. Une étude internationale menée par des chercheurs de l'Université de Californie à San Diego incluant Frédéric Delsuc de l’Institut des Sciences de l'Evolution de Montpellier (ISEM – CNRS/Université de Montpellier/IRD/EPHE) a caractérisé le microbiome intestinal de près de 900 espèces de vertébrés afin d’éclairer cette question. Les résultats publiés dans la revue mBio démontrent l’absence de phylosymbiose chez les oiseaux et les chauve-souris et suggèrent que l’évolution des microbiomes intestinaux a été impactée de façon convergente par les contraintes physiologiques liées à l’adaptation au vol chez ces deux groupes.
La plupart des mammifères, à l’instar de l’être humain, entretiennent des relations étroites avec les microbes constituant notamment leur « flore » intestinale. Les communautés de micro-organismes associés aux organismes multicellulaires constituent le microbiote dont on peut aujourd’hui caractériser la composition et le contenu fonctionnel en gènes (le microbiome) par séquençage à haut débit. L’ensemble des gènes portés par le microbiote est appelé le microbiome dans le sens où il constitue un second génome apportant de nombreuses fonctions à l’hôte auquel il est associé. Chez les vertébrés, le microbiome est ainsi impliqué dans de nombreux processus physiologiques essentiels tels que la digestion et l’immunité.
Des études antérieures ont indiqué que la relation entre les mammifères et leurs microbes intestinaux est très ancienne. Cette coévolution hôte-microbiote sur des dizaines de millions d’années a abouti à une structuration des communautés microbiennes qui reflète l’histoire évolutive des espèces hôtes. Ce phénomène, dénommé phylosymbiose, reflète le fait que des espèces phylogénétiquement proches présentent souvent des microbiomes similaires. On sait que le régime alimentaire et la phylogénie de l'hôte influencent le contenu taxonomique et fonctionnel du microbiome intestinal de nombreux mammifères, mais qu’en est-il à une plus large échelle évolutive telle que celle des vertébrés couvrant des centaines de millions d’années ? La phylosymbiose est-elle aussi observée chez les autres groupes de vertébrés ? Quels autres facteurs déterminent l’évolution et la composition du microbiome des vertébrés ?
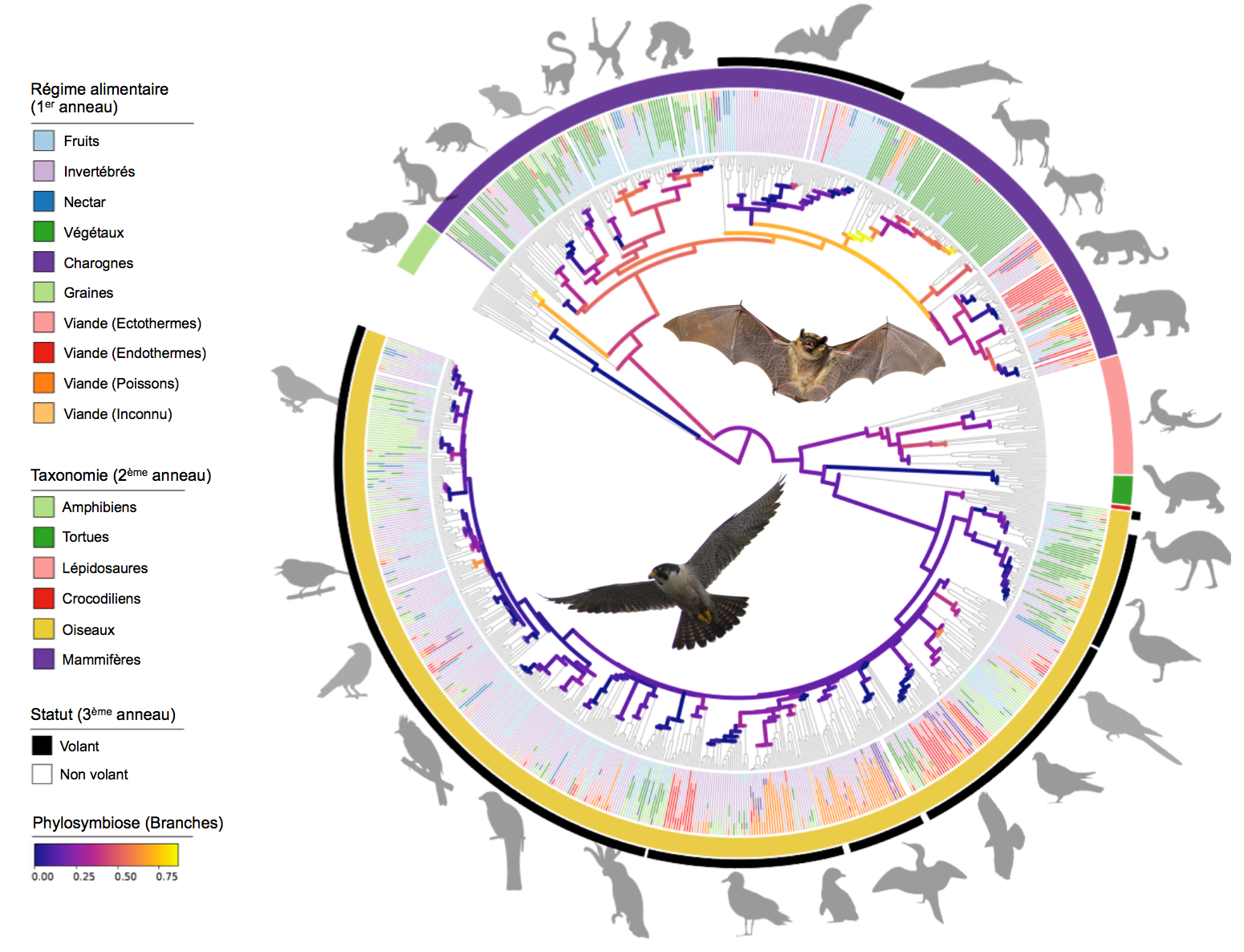
Afin de répondre à ces questions, une équipe internationale a travaillé avec de nombreuses douzaines d'institutions à travers le monde pour recueillir des échantillons fécaux d’espèces de vertébrés. Grâce à cet effort d’échantillonnage sans précédent, les chercheurs ont pu caractériser les microbiomes intestinaux de ∼900 espèces, y compris 315 mammifères et 491 oiseaux, et évaluer les contributions respectives du régime alimentaire, de la phylogénie, et de la physiologie à la structuration des microbiomes intestinaux. Les résultats confirment que chez les mammifères terrestres, il existe de fortes corrélations entre la similarité des communautés microbiennes, le régime alimentaire de l'hôte et la distance phylogénétique de l'hôte, un signal de phylosymbiose étant retrouvé chez les différents ordres. La seule exception chez les mammifères sont les chauve-souris qui hébergent des microbiomes intestinaux relativement labiles et ne montrent pas de corrélation avec le régime alimentaire ou la phylogénie de l'hôte. De façon surprenante, les oiseaux montrent exactement le même patron de perte du signal de phylosymbiose et possèdent aussi des microbiomes intestinaux peu spécifiques et relativement similaires à ceux des chauve-souris. Les seuls oiseaux présentant un patron de phylosymbiose sont les ratites tels que l’autruche et le kiwi qui ont perdu la capacité de voler très tôt dans leur histoire évolutive. Cette constatation suggère que l'adaptation au vol battu a mené au relâchement de la coévolution entre les hôtes et leurs microbes intestinaux associés.
Ces résultats intrigants démontrent que si certains vertébrés ont des relations évolutives étroites avec leurs microbiomes, avec des communautés bactériennes similaires qui persistent depuis des millions d'années, d'autres ont des relations beaucoup plus dynamiques. Les contraintes physiologiques associées à l’adaptation au vol, incluant notamment une réduction du tractus digestif, semblent ainsi avoir eu un effet direct sur le microbiome. Ceci suggère que le microbiome intestinal jouerait un rôle moins important dans la digestion chez les oiseaux et les chauve-souris que chez les vertébrés terrestres. Cette étude fournit un cadre pour de futures approches permettant d'examiner les relations hôte-microbiote à travers de larges échelles taxonomiques et souligne la nécessité d'élucider les détails des interactions entre écologie et histoire évolutive pour mieux cerner leurs rôles respectifs dans la structuration des microbiomes.
Référence
Song S.J., Sanders J.G., Delsuc F., Metcalf J.L., Amato K.R., Taylor M.W., Mazel F., Lutz H.L., Winker K., Graves G.R., Humphrey G., Gilbert J.A., Hackett S.J., White K.P., Skeen H. R., Kurtis S.M., Withrow J., Braile T., Miller M., McCracken K., Maley L., Blanto J.M., McKenzie V. J., Knight R. (2020). Comparative analyses of vertebrate gut microbiomes reveal convergence between birds and bats, mBio.